Elektrokimia
Elektrokimia adalah ilmu yang mempelajari hubungan antara perubahan (reaksi) kimia dengan kerja listrik, yang melibatkan sel elektrokimia dengan menerapkan prinsip reaksi reduksi dalam aplikasinya. Dalam kehidupan sehari-hari penggunaannya sangat banyak, mulai dari pemanfaatan baterei untuk menghidupkan hampir semua peralatan elektronik sampai dengan pelapisan logam pada permukaan logam lain.
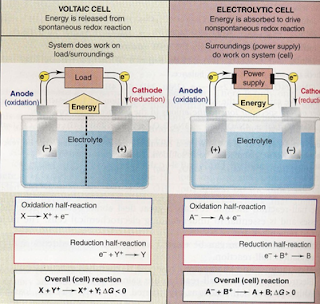
- Sel yang melakukan kerja dengan melepaskan energi dari reaksi spontan,
- Sel yang melakukan kerja dengan menyerap energi dari sumber listrik untuk menggerakkan reaksi non spontan.
Sel elektrokimia, baik yang melepas atau menyerap energi listrik selalu melalui proses perpindahan elektron-elektron dari satu senyawa ke senyawa yang lain dalam suatu reaksi oksidasi reduksi. Oksidasi adalah proses hilangnya elektron, sedangkan reduksi proses diperolehnya elektron. Zat pengoksidasi adalah kelompok zat yang melakukan oksidasi, mengambil elektron dari zat yang teroksidasi. Zat pereduksi adalah kelompok yang melakukan reduksi memberikan elektron kepada zat yang tereduksi.
Setelah reaksi zat teroksidasi memiliki bilangan oksidasi yang lebih tinggi dan zat tereduksi memiliki bilangan oksidasi yang lebih rendah. Sel volta memanfaatkan reaksi spontan (∆G<0) untuk membangkitkan energi listrik. Selisih energi reaktan (tinggi) dengan produk (rendah) diubah menjadi energi listrik. Sel Elektrolisa memanfaatkan energi listrik untuk melakukan reaksi non spontan (∆G > 0) lingkungan melakukan kerja terhadap sistem.
Kedua tipe sel tersebut menggunakan elektroda, yaitu zat yang dapat menghantarkan listrik antara sel dan lingkungan serta dicelupkan dalam elektrolit (campuran ion) yang terlibat dalam reaksi atau yang membawa muatan.
Elektroda
Elektroda dibagi menjadi dua jenis, yaitu anoda dan katoda. Setengah dari reaksi oksidasi terjadi pada anoda. Elektron diberikan oleh senyawa teroksidasi (zat pereduksi) dan meninggalkan sel melalui anoda. Setengah reaksi reduksi terjadi di katoda, elektron diambil oleh senyawa tereduksi (zat pengoksidasi) dan masuk sel melalui katoda.
- Jumlah perubahan kimia yang terjadi dalam sel elektrolisis, sebanding dengan muatan listrik yang dilewatkan dalam sel tersebut.
- Jumlah muatan listrik sebanyak 96.500 coulomb akan menyebabkan perubahan suatu sejumlah sebanyak 1,0 gram ekivalen (grek).
- Setengah sel oksidasi, anoda berupa batang logam Zn dicelupkan dalam ZnSO4.
- Setengah sel reduksi, katoda berupa batang logam Cu dicelupkan dalam CuSO4.
- Terbentuk muatan relatif pada kedua elektroda, anoda bermuatan negatip dan katoda bermuatan positip,
- Kedua sel juga dihubungkan oleh jembatan garam, yaitu tabung berbentuk U terbalik berisi pasta elektrolit yang tidak bereaksi dengan sel redoksi yang digunakan untuk menyeimbangkan muatan ion (kation dan anion),
- Dimungkinkan menggunakan elektroda inaktif yang tidak ikut bereaksi dalam sel volta, misalnya grafit dan platinum.
- Sel Volta dinotasikan dengan cara yang telah disepakati (untuk sel Zn/Cu2+) Zn(s)| Zn2+(aq)║Cu2+(aq)|Cu(s),
- Bagian anoda (setengah sel oksidasi), dituliskan disebelah kiri bagian katoda.
- Garis lurus menunjukkan batas phasa, yaitu adanya phasa yang berbeda (aqueous vs solid) jika phasanya sama maka digunakan tanda koma.
- Untuk elektroda yang tidak bereaksi ditulis dalam notasi diujung kiri dan ujung kanan.


Komentar
Posting Komentar
silahkan berikan komentar